Collagene
COLLAGENE (Collagen)
Il collagene (o collageno) è la principale proteina del tessuto connettivo negli animali.
È la proteina più abbondante nei mammiferi (circa il 25% della massa proteica totale), rappresentando nell’uomo circa il 6% del peso corporeo.
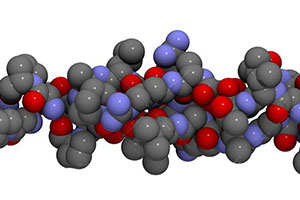
Il collagene è una struttura rigida, rigidità conferita dalla presenza di prolina o idrossiprolina. La più stabile disposizione e riarrangiamento del collagene è quella della tripla elica proprio per la presenza della prolina. L’unità strutturale del collagene è rappresentata dal tropocollagene (o tropocollageno), proteina con una massa molecolare di circa 285 kiloDalton formata da tre catene polipeptidiche con andamento sinistrorso che si associano a formare una tripla elica destrorsa (trans di tipo – 2). Solitamente, per il collagene di tipo I, sono presenti due catene alfa 1 ed una catena alfa 2. Tutte le unità di tropocollagene hanno la stessa lunghezza, la stessa ripetitività di amminoacidi, che implica quindi la presenza della glicina ogni tre residui e dove X e Y sono spesso la prolina Pro e l’idrossiprolina.
I filamenti di tropocollagene sono tenuti insieme da legami idrogeno. questi legami sono possibili grazie alla presenza di glicine e dalle modifiche post-traduzionali di lisina e prolina. Entrambi questi amminoacidi subiscono una ossidazione per aggiunta di un gruppo ossidrile. La prolina è modificata a idrossiprolina dall’enzima Prolil Idrossilasi, che inserisce il gruppo -OH in corrispondenza del secondo carbonio dell’anello; mentre la lisina è modificata a idrossilisina dall’enzima Lisil Idrossilasi, che inserisce il gruppo -OH nel Cδ della catena laterale della lisina. Entrambi gli enzimi agiscono in presenza del co-fattore acido ascorbico e del co-substrato alfa-chetoglutarato. Queste modifiche sono necessarie per aumentare la possibilità di formazione dei legami H e per diminuire l’ingombro sterico. Le tre unità strutturali assumono una forma simile ad una treccia.
Le varie fibre sono legate da legami crociati tra due allisine o tra una lisina e un’ allisina. La lisina è convertita in allisina dall’enzima Lisina Ossidasi, che inserisce al posto del gruppo amminico della catena laterale della lisina in corrispondenza dell’ultimo carbonio (carbonio epsilon) un gruppo aldeidico. Quando avviene il legame crociato si verificherà una condensazione aldolica (sia la lisina che l’allisina sono due aldeidi).